BEACONAG亚娱官方网站制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
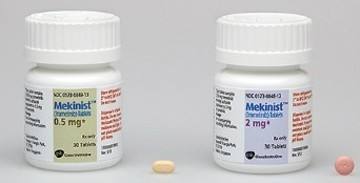
2016年5月4日讯/生物谷BIOON/--近日,诺华黑色素瘤联合疗法Tafinlar (dabrafenib) + Mekinist (trametinib)(达拉菲尼+曲美替尼)获得英国NICE支持批准,用于治疗携带BRAF V600突变的不可切除或转移性黑色素瘤成人患者的治疗。去年9月,该组合疗法获得欧盟审批通过,这次获得NICE支持,标志着该组合疗法在欧洲市场上的进一步扩张。
NICE在审批Tafinlar (dabrafenib) + Mekinist (trametinib)(达拉菲尼+曲美替尼)的过程中省略了一步评估过程,因为NICE推荐的适应症与该药物已获批的适应症一致。数据显示,与其它治疗方法相比,该组合疗法能够将患者的生存期多延长六个月,这对于不可切除性及转移性黑色素瘤患者而言是一个非常可观的数字。
通常,晚期黑色素瘤患者的生存期少于两年。晚期黑色素瘤患者中,一半以上都携带BRAF V600阳性突变,NICE批准该组合疗法有助于这部分患者尽快获得有效的治疗。
NICE医疗技术评估中心负责人Carole Longson教授表示,Tafinlar (dabrafenib) + Mekinist (trametinib)(达拉菲尼+曲美替尼)这一组合疗法是针对晚期黑色素瘤患者非常有效的一线新药,能够显着延长患者的生存期。目前的数据充分表明该组合疗法的效果,医生和患者都非常欢迎NICE做出的推荐决定。
诺华对NICE的积极推荐决定表示欢迎,诺华英国及爱尔兰肿瘤部门负责人Barbara McLaughlan表示,NICE的积极推荐决定表明该组合疗法已经获得了患者和专业医护人员的肯定,对晚期黑色素瘤患者而言,是一项重要的突破。
据悉NHS已经和诺华达成了未披露的折扣价格,然而每28天疗程的价格依旧达到了10080英镑。去年3月,制药行业两大巨头葛兰素史克(GSK)与诺华(Novartis)完成价值220亿美元的一系列资产置换,重塑各自的核心业务。其中,诺华以160亿美元收购葛兰素史克的肿瘤业务,这一组合疗法就来源于这次资产置换。Tafinlar为BRAF抑制剂,作为一种单药口服胶囊,适用于携带BRAF V600E突变的手术不可切除性黑色素瘤或转移性黑色素瘤成人患者的治疗。Mekinist为首个MEK抑制剂,作为一种单药口服片剂,适用于携带BRAF V600E或V600K突变的手术不可切除性黑色素瘤或转移性黑色素瘤成人患者的治疗。(生物谷Bioon.com)